اسید نیتریک یکی از مهمترین و پرکاربردترین اسیدهای معدنی در جهان است. این ماده با فرمول شیمیایی HNO₃، نقشی کلیدی در صنایع شیمیایی، کشاورزی، تولید مواد منفجره، داروسازی و حتی آزمایشگاههای تحقیقاتی دارد. اسید نیتریک در حالت خالص، مایعی بیرنگ با بوی تند و خاص است که بهدلیل قدرت اکسیدکنندگی بالا، در تماس با پوست و مواد آلی میتواند باعث سوختگی یا واکنشهای شدید شود.
در این مقاله به بررسی جامع اسید نیتریک، ساختار مولکولی، خواص فیزیکی و شیمیایی، روشهای تولید و مهمترین کاربردهای صنعتی آن خواهیم پرداخت.
تاریخچه کشف و شناخت اسید نیتریک
اسید نیتریک از قرن هشتم میلادی شناخته شده است. کیمیاگران مسلمان همچون جابر بن حیان (پدر شیمی نوین) از طریق تقطیر ترکیبی از نیتراتها با زاج سبز، موفق به تهیه نوعی اسید خورنده شدند که بعدها با نام «روح نیترا» (spirit of niter) شناخته شد. در قرن هجدهم میلادی، با پیشرفت علم شیمی، ساختار و ترکیب دقیق این اسید مشخص شد و تولید صنعتی آن در قرن نوزدهم آغاز گردید.
امروزه تولید اسید نیتریک در مقیاس وسیع، پایه و اساس بسیاری از صنایع شیمیایی مدرن محسوب میشود.

فرمول و ساختار مولکولی اسید نیتریک
فرمول شیمیایی اسید نیتریک HNO₃ است.
مولکول آن شامل یک اتم هیدروژن، یک اتم نیتروژن و سه اتم اکسیژن میباشد. نیتروژن در این مولکول در حالت اکسیداسیون +5 قرار دارد. ساختار مولکولی آن بهصورت زیر است:
H–O–N(=O)₂
این ساختار باعث میشود پیوندهای قوی قطبی در مولکول ایجاد شود و اسید نیتریک خاصیت اسیدی و اکسیدکنندگی بسیار بالایی داشته باشد.
خواص فیزیکی اسید نیتریک
| ویژگی | مقدار یا توضیح |
| ظاهر | مایع بیرنگ یا زرد کمرنگ |
| بوی خاص | تند و خفهکننده |
| حلالیت در آب | کاملاً محلول |
| pH | بسیار پایین (حدود 1 یا کمتر) |
خواص شیمیایی اسید نیتریک
اسید نیتریک یکی از قویترین اکسیدکنندهها در میان اسیدهای معدنی است. در واکنش با بیشتر فلزات، گازهای اکسید نیتروژن تولید میکند. برخی ویژگیهای مهم شیمیایی آن عبارتند از:
🔴1. خاصیت اسیدی قوی
بهراحتی پروتون (H⁺) آزاد میکند و در واکنشهای اسید-باز شرکت میکند.
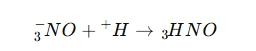
🔴2. خاصیت اکسیدکنندگی
میتواند بسیاری از مواد فلزی و غیرفلزی را اکسید کند. بهعنوان مثال:
![]()
در این واکنش مس به نیترات مس (II) تبدیل میشود و گاز دیاکسید نیتروژن آزاد میگردد.
🔴3. تشکیل نیتراتها
اسید نیتریک در واکنش با بازها یا فلزات، نمکهایی به نام نیتراتها (Nitrates) تولید میکند.
این ترکیبات در صنایع کود شیمیایی اهمیت زیادی دارند.
🔴4. تجزیه حرارتی
در دمای بالا یا در حضور نور، اسید نیتریک ناپایدار است:
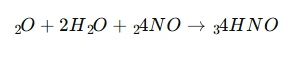
روشهای تولید اسید نیتریک
🔴1. فرآیند استوالد (Ostwald Process)
اصلیترین روش صنعتی تولید اسید نیتریک، فرآیند استوالد است که بر پایه اکسیداسیون آمونیاک بنا شده است. مراحل این فرایند عبارتند از:
⭐اکسیداسیون آمونیاک
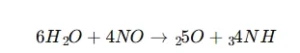
این واکنش در حضور کاتالیست پلاتین-رودیوم در دمای حدود 900°C انجام میشود.
⭐تبدیل مونوکسید نیتروژن به دیاکسید نیتروژن
⭐جذب NO₂ در آب و تولید HNO₃
![]()
گاز NO آزادشده مجدداً به مرحله دوم برمیگردد و بازیافت میشود.
این فرآیند کارآمد، اقتصادی و پایهی اصلی تولید جهانی اسید نیتریک است.
🔴2. روشهای آزمایشگاهی
در مقیاس کوچک، اسید نیتریک را میتوان با واکنش **نیترات سدیم (NaNO₃)** یا **نیترات پتاسیم (KNO₃)** با اسید سولفوریک غلیظ تولید کرد:
![]()
انواع اسید نیتریک از نظر غلظت

🔹1. اسید نیتریک رقیق
دارای غلظت کمتر از 68٪ است و بیشتر در مصارف آزمایشگاهی و آموزشی استفاده میشود.
🔹2. اسید نیتریک غلیظ
حدود 68 تا 70٪ HNO₃ دارد و در صنایع شیمیایی و فلزکاری کاربرد دارد.
🔹3. اسید نیتریک دودکننده
دارای غلظت بیش از 90٪ بوده و بخارات قهوهای رنگ NO₂ از آن متصاعد میشود. این نوع، بسیار خطرناک و خورنده است و در صنایع نظامی و موشکی استفاده میشود.
کاربردهای صنعتی اسید نیتریک
اسید نیتریک یکی از پرکاربردترین مواد در صنایع مختلف است. برخی از مهمترین کاربردهای آن عبارتند از:
🔴1. تولید کودهای شیمیایی
بیش از 70 درصد از اسید نیتریک تولیدی جهان برای ساخت کودهای شیمیایی مصرف میشود.
در واکنش با آمونیاک، ترکیباتی مانند نیترات آمونیوم (NH₄NO₃)، نیترات پتاسیم (KNO₃) و نیترات کلسیم (Ca(NO₃)₂) تولید میشود که از منابع اصلی نیتروژن در کشاورزی هستند.
🔴2. تولید مواد منفجره
اسید نیتریک یکی از اجزای اصلی در تهیه نیتراتهای آلی مانند نیتروگلیسیرین، TNT (ترینیتروتولوئن) و نیتروسلولز است.
این مواد در صنایع نظامی، معدنی و عمرانی کاربرد گسترده دارند.
🔴3. فرایندهای فلزکاری
در صنایع فلزات برای پولیش، حکاکی، تمیزکاری و اسیدشویی از اسید نیتریک استفاده میشود.
برای مثال در ساخت استیل ضدزنگ، از محلولهای رقیق HNO₃ جهت حذف ناخالصیهای سطحی بهره میگیرند.
🔴4. صنایع دارویی و شیمیایی
در تولید ترکیبات نیتروآروماتیک، رنگها، رزینها و برخی داروها مانند نیترات نقره از این اسید استفاده میشود.
🔴5. کاربرد در سوخت و صنایع هوافضا
در برخی سامانههای پیشران موشکی، از اسید نیتریک دودکننده قرمز (RFNA) بهعنوان اکسیدکننده در ترکیب با سوختهای مایع استفاده میشود.
🔴6. استفاده در آزمایشگاهها
بهدلیل خلوص بالا و قدرت واکنشپذیری زیاد، اسید نیتریک یکی از مواد اصلی برای آنالیز شیمیایی، حل فلزات، آمادهسازی نمونهها و تجزیه مواد معدنی است.
خطرات و نکات ایمنی اسید نیتریک
اسید نیتریک مادهای بسیار خورنده، سمی و خطرناک است. تماس آن با پوست میتواند منجر به سوختگی شیمیایی و زرد شدن بافت شود. استنشاق بخارات آن باعث تحریک شدید دستگاه تنفسی و آسیب ریوی خواهد شد.
نکات ایمنی هنگام کار با اسید نیتریک
🔺استفاده از دستکش مقاوم، عینک ایمنی و روپوش آزمایشگاهی الزامی است.
🔺در محیط دارای تهویه مناسب یا زیر هود شیمیایی کار شود.
🔺 از تماس با فلزات، مواد آلی و بازها خودداری شود.
🔺در صورت تماس با پوست، فوراً با آب فراوان شستوشو داده شود.
🔺باید در ظروف شیشهای یا پلیاتیلنی مقاوم در برابر اسید، در مکان خنک و دور از نور نگهداری شود.
اثرات زیستمحیطی
اسید نیتریک و ترکیبات حاصل از آن در صورت رها شدن در محیط میتوانند باعث آلودگی خاک و آب شوند. گازهای نیتروژن اکسید حاصل از تجزیه اسید نیتریک در جو، به تشکیل باران اسیدی کمک میکنند که برای گیاهان و اکوسیستمها مضر است.
به همین دلیل، صنایع تولیدکننده موظف به استفاده از سیستمهای کنترل انتشار NOₓ هستند تا از آلودگی هوا جلوگیری شود.
تهیه اسید نیتریک از نیلرنگ
اگر به اسید نیتریک باکیفیت برای مصارف صنعتی یا آزمایشگاهی نیاز دارید، میتوانید آن را از نیلرنگ تهیه کنید.
نیلرنگ با ارائهی گریدهای متنوع (تحقیقاتـی، صنعتی و دودکننده)، امکان انتخاب دقیق متناسب با کاربرد شما را فراهم میکند.
جمعبندی
اسید نیتریک، ترکیبی قدرتمند و حیاتی در دنیای شیمی است که از قرنها پیش تاکنون، نقش مهمی در پیشرفت علم و صنعت ایفا کرده است. از تولید کودهای نیتروژنه تا ساخت مواد منفجره و کاربرد در آزمایشگاهها، این اسید جایگاهی غیرقابل جایگزین دارد.
با وجود کاربردهای گسترده، باید به خطرات زیستمحیطی و ایمنی آن توجه ویژه داشت. رعایت دستورالعملهای ایمنی، مدیریت پسماند و کنترل انتشار گازهای NOₓ از مهمترین مسئولیتهای صنایع مرتبط با تولید و مصرف اسید نیتریک است.








